基礎研究
ベーチェット病の病態解明
免疫異常疾患研究室、⾼松漂太室⻑が⼤阪⼤学在籍中に、厚⽣労働省が難病認定している「ベーチェット病」の病態解明に関する研究に取り組んでいました。そして、エクソソームに包まれたmtDNAが重要な役割を担っていることを見出しました。その成果について、The EMBO Journal 誌に掲載されました。研究内容については以下をご覧ください。
(説明文) ベーチェット病の病態解明
(映像) 「ベーチェット病」の原因物質特定 阪大の研究グループが発表 NHK 関西のニュース
SLEの病態解明、疾患層別化、新規治療法の開発
皮膚筋炎に合併する急速進行性間質性肺炎の病態解明
Lysosome膜上のRagulator複合体の免疫における役割
1細胞機能と1細胞遺伝子発現情報を紐付けるプラットフォーム開発
空間トランスクリプトームを用いた膠原病血管炎の解析
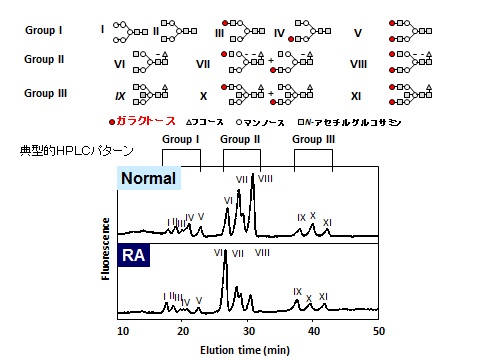
関節リウマチ(RA)における免疫グロブリン糖鎖異常(ガラクトース欠損)の役割
ガレクチンとは、ガラクトースと結合可能で、糖鎖同士を架橋する蛋白質である。ガレクチン3(Galectin-3)はガレクチンのファミリーに属する1個の糖鎖結合ドメイン(CRD)とN末端側領域から構成されるキメラタイプのガレクチンで、細胞増殖・分化やアポトーシスの制御など多彩な生理活性が知られており、マクロファージによる貧食や炎症にも関与する。我々はGalectin-3 binding protein (Gal-3BP)、Gal-3の発現がRAの関節局所で亢進していることを明らかにし報告した(※2)。一方、糖鎖による修飾は、発生過程や、癌化の過程で変化が認められることが知られている。RAにおいても血清IgGの糖鎖のガラクトースの量の減少が報告されている(※3)。関節リウマチ(RA)は代表的な慢性炎症性疾患であるが病因は未だ明らかになっておらず、そのため根本的な治療法は確立されていない。病態としては、自己の免疫グロブリン(IgG)に対する自己抗体であるリウマチ因子(RF)の産生と、その結果形成される免疫複合体が滑膜、骨・軟骨、血管壁などに沈着し、炎症を引き起こすといった機序も考えられている。これまでの研究から、RA症例の血清IgGでは糖鎖異常が認められることが報告されており、このことはIgGの免疫原性に影響を与え、RFを含めた自己抗体の産生に関わると考えられる。さらにその生理機能や炎症反応への関与が報告されており、エフェクター機能の発現にも重要な役割を果たしていることが明らかになってきたが、詳細な糖鎖構造の解析と病因への関与のメカニズムにまでふみこんだ報告はない。
ヒトIgGは、CH2領域の297番目のアスパラギンに2本の糖鎖を有する。我々は、共同研究者近藤らの開発した液体クロマトグラフィー(HPLC)を用いた最新の糖鎖解析の手法(※4)によりRA症例の血清中のIgGのN型糖鎖構造を詳細に解析した。この糖鎖構造は基本的に2本鎖であり、ガラクトースの欠損以外にも、フコース、Nーアセチルグルコサミンにも欠損がみられることがあり、11種の多様性が見られる。結果、診断のついたRAにおいては、健常人や変形性関節症の症例に比して、ガラクトースを欠損した糖鎖を有するIgGの割合が極めて高いという特徴を確認した。また、この現象が発症のかなり早期から起こっており、発症原因のひとつである可能性を示唆する知見を得ている。すなわち、ガラクトースを欠損したIgGの割合(%G0)が、が早期RAの診断マーカーとして有用であることを明らかにした。
また、マウスの関節炎モデルにおいては、ガラクトースを欠損したII型コラーゲンに対するIgGを移入することで病態がより悪化し、糖鎖異常が病因に関わっているとの報告がみられた(※5)。糖タンパク質における糖鎖は、糖タンパク質の立体構造にも関わり、安定性を保持する役割が知られており、また、生理機能における役割も担っている。糖鎖異常によって立体構造が変わることは、免疫原性に関わると考えられ、RFや抗ガラクトース欠損IgG抗体の産生に関わっていることが示唆される。また、ガラクトースの欠損は、IgGの重要な生理機能である補体の活性化やFc受容体への結合能を著しく損なうことが明らかになっている(※6)。RA患者における血清IgGのガラクトース欠損は、IgGを産生するB細胞のβ1,4ガラクトース転移酵素の異常によるものである可能性がある。RA患者のB細胞においてβ1,4ガラクトース転移酵素活性が健常人に比して30-70%減少しているという報告もあるが、否定的な報告もある。また近年β1,4ガラクトース転移酵素は、遺伝子ファミリーを形成していることも明らかになっており(※7)、今後どのβ1,4ガラクトース転移酵素が、B細胞においてIgG糖鎖にガラクトースを付加することに主要な働きをしているのか、更なる研究が待たれる。興味深いことに、和田らとの共同研究において、質量分析法を用いた糖タンパク質糖鎖解析法を用いてIgG糖鎖異常のみならず、IgA1におけるO型糖鎖異常を初めて報告した(※8)。RA症例の血清中の免疫グロブリンの糖鎖構造の異常と臨床データの関連を詳細に検討することは、RAの早期診断や予後の評価につながると考えられる(※9)。すでに診断においては、水落らが開発した抗ガラクトース欠損IgG抗体が臨床の場で使用されている。しかし、特にRAの病因解明のためには、糖鎖異常を起こした免疫ブロブリンに対する抗体を解析すること以上に糖鎖異常の起こっている免疫グロブリンそのものを解析することが重要であることはいうまでもなく、またそれを可能とする技術を我々は手に入れつつある。近年の糖鎖の構造解析、機能解析に関する技術進歩は著しく、今後これらの技術を用いて糖鎖の機能を解明することにより核酸や蛋白質だけで説明できなかった様々な生命現象が解明されるようになることが期待される。RAにおける糖鎖異常を引き起こすメカニズムを分子レベルで明らかにすることにより発症のメカニズムが解明されれば、RAの根本的な治療につながるものと考えられる。
※文中の番号は参考文献と対応しています。
(1) Ohshima S, Kuchen S, Seemayer CA, Kyburz D, Hirt A, Klinzing S, Michel BA, Gay RE, Liu FT, Gay S, Neidhart M. Galectin 3 and its binding protein in rheumatoid arthritis. Arthritis Rheum. 2003 Oct;48(10):2788-95.
(2) Parekh, RB, Dwek, RA, Sutton, DJ, Fernandes, DL, Leung, A, Stanworth, D, Rademacher, TW, Mizuochi, T, Taniguchi, T, Matsuta, K,Takeuchi, F, Nagano, Y, Miyamoto, T, Kobata, A : Association of rheumatoid arthritis and primary osteoarthritis with changes in the glycosylation pattern of total serum IgG. Nature, 316, 452-457, 1985
(3) Kondo A. Kiso M. Hasegawa A. Kato I. Separation of pyridylamino oligosaccharides by high-performance liquid chromatography on an amine-bearing silica column. Anal Biochem 1994, 219, (1), 21-5.
(4) Rademacher TW, Williams P, Dwek RA. Agalactosyl glycoforms of IgG autoantibodies are pathogenic. Proc. Natl. Acad. Sci. USA, 91, 6123-6127, 1994
(5) Tsuchiya N, Endo T, Matsuta K, Yoshinoya S, Aikawa T, Kosuge E, Takeuchi F, Miyamoto T, Kobata A. Effects of galactose depletion from oligosaccharide chains on immunological activities of human IgG. J. Rheumatol. 16, 285-290, 1989
(6) Furukawa K, Sato T. beta-1,4-Galactosylation of N-glycans is a complex process. Biochim. Biophys. Acta, 1473, 54-66, 1999.
(7) Wada Y, Tajiri M, Ohshima S. Quantitation of saccharide compositions of O-glycans by mass spectrometry of glycopeptides and its application to rheumatoid arthritis. J Proteome Res. 2010 Mar 5;9(3):1367-73.
(8) Ohshima S. Rheumatoid arthritis and IgG as biomarker Glycoscience: biology and medicine: 2015:1297-1301
生物学的製剤(Bio)中断解析: TNF阻害剤効果不十分の分子メカニズム
近年の薬物療法のめざましい進歩により、現在、RAにおいては寛解を目指した治療も可能となった。その進歩の最大の原動力は、TNF、IL-6などの炎症性サイトカインやT細胞をターゲットとしたモノクローナル抗体、可溶性レセプターなどの、いわゆる生物学的製剤(Bio)による治療の登場であると言って過言ではない。しかしながら、Bioをより安全に、より有効に使用するために解決すべき主な課題として、(1) 効果不十分(治療抵抗性) (2) 高コスト (3)副作用(重症の感染など)がある。この中でも、本研究では、(1) 効果不十分(治療抵抗性)の原因を解明することにより、Bio治療における分子標的の的確な選択に貢献できると考える。
1.喫煙の影響、AhRシグナル
国立病院機構(NHO)の施設を中心に全国の主な40のRA医療の基幹施設からなる独自のリウマチ臨床研究ネットワーク(iR-net)からなる、わが国で最大(登録患者1万人以上)のRA患者の臨床データベース(Ninja : National Database of rheumatic disease by iR-net in Japan)に参加し、RAに関する医療の現状を分析し、その課題、問題の抽出を行ってきた(3)。その活動の中で、このデータベースを利用し、実臨床におけるBioの使用状況、とくにBio使用中断についてその理由を解析してきた。Bio中断理由を (1) 効果不十分、(2) 副作用、(3) 寛解の3つのカテゴリーに分け横断的解析を行い、「効果不十分」によるBio中断と「喫煙」習慣との関連を検討した結果、喫煙者の場合、非喫煙者と比べ「効果不十分」によるBio中断症例が有意に多いことを明らかにした。また、禁煙者は喫煙者に比べBio中断症例が有意に少ないことを示し、禁煙することによりBioの効果が復元する可能性があることを示唆する結果を報告した(EULAR 2014, Paris)。
従来、「喫煙」は、RAにおいて、その病因(環境因子)として、また治療効果との関連がとくに注目され、その分子メカニズムにおける喫煙凝縮物質(CSC: cigarette smoke condensate)のリガンドの一つであるaryl hydrocarbon receptor (AhR)シグナルの研究が進められている。AhRシグナルは免疫系への関与も報告され、炎症の主要シグナル経路であるNF-κBシグナル経路を活性化することからも、「喫煙」のRAの病態への影響の分子メカニズムのひとつとして注目されている。本研究では、上述のRA患者の臨床データベース解析から得た、「喫煙」がRAにおけるBio、IL-6阻害剤ではなく、とくにTNF阻害剤の治療効果に影響するとの結果と、AhRシグナルがTNFシグナルと同様にNF-κB経路を活性化するとの事実から、AhRシグナルとTNFシグナル間のクロストークを分子メカニズムから解明しようとするものである。(平成27年度 文部科学省科学研究費 基盤C)
2.A20遺伝子変異について
近年、TNF刺激により産生されるA20というTNFの作用(NF-κBシグナル)のブレーキ役をする分子が発見され、その異常(変異)とRAをはじめとするさまざまな病気との関連が報告されている。このようなことを背景に、我々はTNF阻害剤一次無効の原因のひとつとして、A20遺伝子変異が関与しているのではないかとの着想に至った。現在TNF阻害剤一次無効症例において、A20 exon領域における遺伝子変異を解析中である。A20変異によるTNFシグナル-NF-κB活性化経路の機能解析を行うことで、TNF阻害剤無効症例における原因を明らかにし、TNF阻害剤治療の大きな課題である一次無効を予知し、その回避を可能にすることが期待できる。(平成29年度NHOネットワーク共同臨床研究)
(1) Saeki Y, Matsui T, Saisho K, Tohma S. Current treatments of rheumatoid arthritis: from the 'NinJa' registry. Expert Rev Clin Immunol. 2012 Jul;8(5):455-65
臨床研究
早期関節リウマチ患者における生物学的製剤による寛解導入(特にBIO FREE寛解)に関する研究 THE RAINBOW STUDY
近年、関節リウマチ(RA)の治療は、生物学的製剤の登場により、飛躍的に改善・進歩した。特に生物学的製剤(BIO)が、現在その中心的役割を果たしている。一方、大規模臨床研究により、RAの治療においては、“早期治療介入”と“タイトコントロール”の重要性が明白になってきた。さらに寛解達成後、効率よく薬物を中止しても維持される(BIO FREE)寛解まで達成できれば、RAの予後を改善するだけでなく、生物学的製剤の最大の問題である高コストの問題が解決できるものと考えられる。我々は発症2年以内の早期RA患者において生物学的製剤を十分量投与することにより寛解(BIO FREE)の達成率を検討することを主目的とし、多施設共同研究を行った。
発症2年未満のメソトレキサート抵抗性のRA症例が対象。インフリキシマブ(IFX; n=25)またはトシリズマブ(TCZ; n=53)投与後、寛解基準(DAS28ESR<2.6かつステロイド投与量プレドニゾロン換算で≦5mg/day)を6か月間以上維持できた症例はBioを休薬する。1年後ステロイド増量なく DAS28ESR<2.6が維持できた症例をBio-free remissionと定義し達成率を検討した。 THE RAINBOW STUDY 1年時での成績として第1報を、第60回日本リウマチ学会(2016)で報告し、2年時までの第2報について第61回日本リウマチ学会(2017)で報告した。
本研究の成果は、障害の少ない“Window of Opportunity”期での効率のよい寛解導入法、とくにBIO FREE寛解導入法の確立につながり、RA患者の運動機能・身体障害の軽減・抑止、また高コストの生物学的製剤使用量を減らすことが可能となり、社会的、医療経済的に多大な貢献をすることが期待できる。(関西分子標的治療研究会)
感染症の新規バイオマーカー プレセプシンに関する研究
自己免疫性疾患において炎症性サイトカインが病態形成に重要な役割を果たすことが明らかとなり、それらの炎症性サイトカインを制御する治療が可能な時代となってきた。一方、自己免疫性疾患において感染症は生命予後を脅かす重要な合併症の1つであり、感染症時に用いられるマーカーも炎症性サイトカインにより影響を受けることから、感染症マーカーの上昇が、感染症を反映しているのか、原疾患が悪化しているのか鑑別に苦慮することは少なくない。
遠藤らは可溶性CD14分子(soluble CD14: sCD14)のうち、13kDaのsCD14サブタイプを発見し、これを「プレセプシン(presepsin; P-SEP)」と命名し、敗血症における感染症マーカーとしての有用性を報告した。我々はP-SEPを用いてRAにおける感染症マーカーとしての有用性について検討した。結果、P-SEPはRA患者においてRAの疾患活動性によらず感染症の診断、治療効果判定に有効なマーカーであると考えられこれを報告した。
(10) Tsuji S, Kitatoube A, Kikuchi-Taura A, Oguro E, Shigesaka M, Okita Y, Shimizu T, Nii T, Teshigawara S, Tanaka E, Harada Y, Matsushita M, Hashimoto J, Ohshima S, Takahashi G, Endo S, Saeki Y. Elevated soluble CD14-subtype (PRESEPSIN; P-SEP) levels in rheumatoid arthritis (RA) patients with bacterial infection. Mod Rheumatol. 2016 Oct 27:1-3.
全身性エリテマトーデスの活動性マーカーCD64に関する研究
全身性エリテマトーデス(SLE)の発症機序に、樹状細胞から産生されるIFN-αが深く関与していることが報告され、近年、IFN-α阻害療法も開発されつつある。IFN-αの刺激によって単球上CD64(mCD64)が高発現することがすでに報告されており、フローサイトメーターを用いて測定することが可能となっていたが、これまでmCD64分子数値を用いて定量し、SLEの疾患活動性を評価した報告はない。我々はactive SLE 10例とinactive SLE 19例を対象とし、mCD64分子数値およびIFN-α、SLEの疾患活動性であるSLEDAI、抗ds-DNA抗体を用いて比較検討した。
Active SLEのmCD64は39800±16609分子数/細胞で、inactive SLEよりも有意に高値(p<0.001)であり、active SLEの治療後に有意な低下(p=0.01)を認めた。mCD64とSLE 29例のSLEDAIと有意な相関を認めた(r=0.666, p<0.001)。また、IFN-αもactive SLEで有意に高値 (p<0.05)を示し、mCD64とも有意な相関を認めた(r=0.608, p<0.001)。
mCD64分子数値は、ROC解析でAUC 0.837、感度70.7%、特異度94.7%と抗ds-DNA抗体、C3に比べ高く、SLE活動性指標としての有効性が示唆された。
さらにmCD64とSLEは病態・病型との関係を明らかにするために研究を続けている。(平成27年度NHOネットワーク共同臨床研究)
(11) Kikuchi-Taura A, Yura A, Tsuji S, Ohshima S, Kitatoube A, Shimizu T, Nii T, Katayama M, Teshigawara S, Yoshimura M, Kudo-Tanaka E, Harada Y, Matsushita M, Hashimoto J, Saeki Y. Monocyte CD64 expression as a novel biomarker for the disease activity of systemic lupus erythematosus. Lupus. 2015 Sep;24(10):1076-80.
抗CCP抗体高値陽性の診断未確定多関節炎(UA)患者における早期治療介入の関節リウマチ(RA)発症抑止に関する前向き研究
診断不確定の多関節炎(UA)症例において抗CCP抗体が関節リウマチ(RA)の発症予測に有用であることが報告されている。またRAにおいて早期治療介入がその予後改善に寄与することが示唆されている。本研究では、抗CCP抗体高値陽性UA患者を対象とし、(1)MTXを用いたRAに対する標準的治療群 (2)MTX以外の対症療法を行なう群 の2群において、一年間経過観察し、主項目としてRAの発症、副項目として骨破壊、骨塩量の変化および有害事象の発現を検討し、早期治療介入によるRAの発症の抑止に関してその有効性を明らかにした。
(12) Kudo-Tanaka E, Shimizu T, Nii T, Teshigawara S, Yoshimura M, Watanabe A, Tsuji S, Tsuboi H, Hirao M, Yura A, Harada Y,Sueishi M, Suenaga Y, Chiba N, Tonai T, Saisho K, Ogata A, Matsushita M, Hashimoto J, Ohshima S, Tohma S, Saeki Y. Mod Rheumatol. 2015 Mar 24:1-31
スタッフ紹介
- 高松 漂太 (免疫異常疾患研究室長)
- 大島 至郎 (臨床研究部長、免疫疾患センター部長、治験管理室長、臨床研修管理室長)
- 橋本 淳 (統括診療部長)
- 中林 晃彦 (リウマチ・膠原病科医長)
- 吉村 麻衣子(リウマチ・膠原病科医師)
- 西垣内 陽 (リウマチ・膠原病科医師)
- 辻井 敦子 (リウマチ・膠原病科専攻医)
- シリポン・ブティコン・ヤナカーウィ (リウマチ・膠原病科専攻医)
- 平尾 眞 (骨・運動器疾患センター部長、骨・運動器疾患研究室長、リウマチ関節外科)
- 秋田 鐘弼 (整形外科医長、リウマチ関節外科)
- 岡村 元佑 (整形外科医師)
- 奥田 みゆき(呼吸器・アレルギー内科医長)
- 原田 芳德 (呼吸器・アレルギー内科医師)
- 本多 英弘 (呼吸器・アレルギー内科医師)
- 神戸 寛史 (呼吸器・アレルギー内科医師)
- 田村 奈緒子(呼吸器・アレルギー内科専攻医)
- 工藤 慶太 (腫瘍内科医長、がん研究室長)
- 中島 早希 (腫瘍内科医師)
- 渡邊 暁 (腫瘍内科医師)
- 吉田 均 (血液内科部長)
- 村上 雅樹 (血液内科医長)
- 飯尾 健一郎(腎臓内科医師)
- 加藤 麻衣子(皮膚科医長)
- 中谷 ますみ(リウマチ・膠原病科コーディネーター)
- 金田 実穂 (データマネージャー)
- 上杉 祐代 (秘書)
- 内芝 恵子 (秘書)
- 上尾 結子 (秘書)


